在过去的十年间,基于T细胞的免疫疗法已经在肿瘤的治疗中取得了极大的成功,尤其是免疫检查点抑制剂(ICIs)的问世,彻底改变了肿瘤的治疗格局。ICIs通过解除对免疫系统的抑制,使得T细胞能够更有效地识别和攻击肿瘤细胞,从而为许多患者带来了新的希望。然而许多患者仍面临生存期短、复发率高等严峻挑战。T细胞衔接器(T cell engager, TCE)作为一种新兴的免疫疗法,精准地利用身体的免疫系统,引导T细胞攻击肿瘤细胞,为癌症免疫疗法提供了一种有前途的策略。
本期有幸邀请到来自西安交通大学第一附属医院的姚煜教授,从T细胞衔接器的结构和作用机制角度为我们解读塔拉妥单抗为小细胞肺癌患者带来的生存希望。
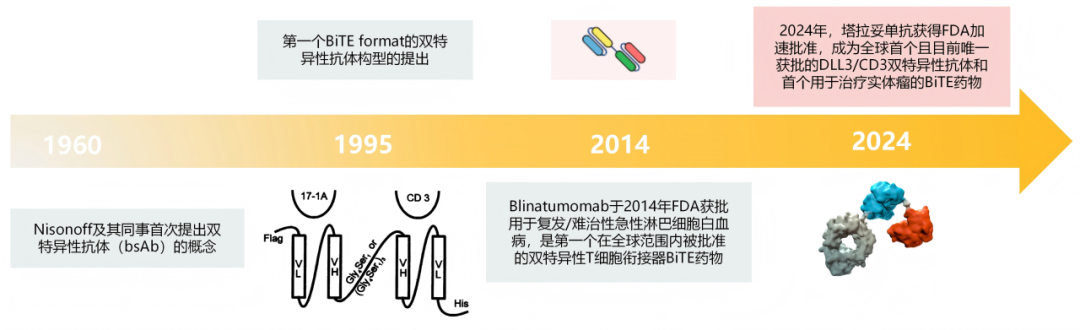
BiTE疗法的诞生
双特异性抗体(Bispecific antibody, bsAb)的最初概念是由美国纽约罗斯威尔公园纪念研究所的Nisonoff教授和他的研究团队在1960年Science发表的一篇论文中首次提出的。双靶向治疗的概念随即显示出了巨大的治疗前景,这种双特异性的组合的核心优势在于能产生单抗无法实现的"分子桥梁"效应,可以桥接两种细胞类型(跨细胞结合,in-trans binding,如Blinatumomab连接CD19+ B细胞与CD3+ T细胞)或作用于同一细胞膜上的两个分子(同细胞结合,in-cis binding,如同时靶向EGFR和c-Met抑制肿瘤信号通路)。然而,将此概念转化为临床治疗的过程充满了挑战。由于肿瘤部位T细胞浸润不足,导致免疫治疗在实体瘤中的响应率非常有限,极大地限制了疗效的发挥。为解决这些问题,对抗体构造的修改以及寻找旨在进一步提高治疗疗效并降低毒性的联合策略已成为迫切问题。将T细胞重新定向的双特异性T细胞衔接器(Bispecific T cell Engager, BiTE)疗法则是目前最具前景的治疗策略之一。双特异性T细胞衔接器(BiTE)是一种新型免疫治疗方法,旨在通过同时识别肿瘤细胞和T细胞来增强抗肿瘤免疫反应。第一个BiTE format的双特异性抗体出现在1995年发表在PNAS的一篇论文上。这种构建方式能够将T细胞直接引导至肿瘤细胞,从而促进肿瘤细胞的破坏,而天然的抗体则无法实现这一功能。
Fig.1 BiTE发展历程
BiTE抗体的构建
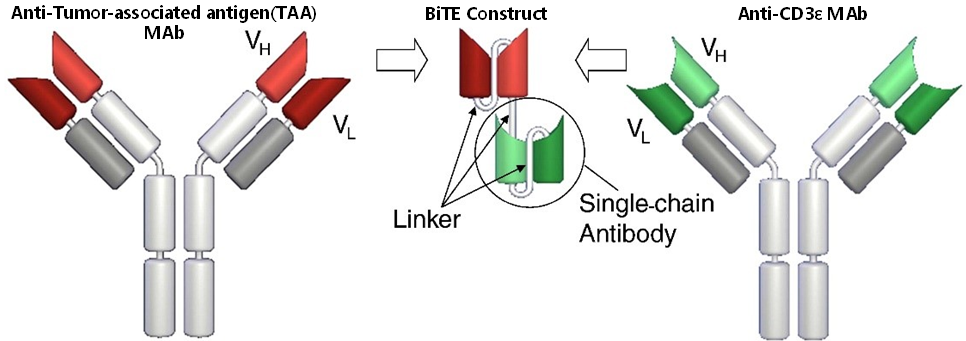
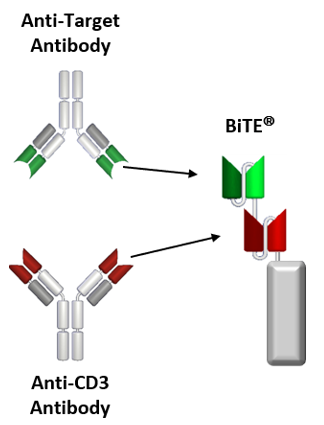
双特异性T细胞衔接器(BiTE)包含两个结合位点,分别由来自两个单克隆抗体的片段组成,一个结合肿瘤细胞表面抗原TAA,例如,BCMA、CD19、δ样蛋白3(DLL3);另一个结合T细胞表面CD3分子。每种抗体的重链可变区(VH)和轻链可变区(VL)融合成单链抗体,通过一个非免疫原性的短肽连接形成完整的BiTE构造。
Fig.2 BiTE抗体构建
然而,经典的BiTE抗体仅由两个scFv(single-chain variable Fragments)组成,是一种非IgG样双抗,没有能够延长循环时间的Fc结构域,因此这种小分子可以通过肾脏快速清除,半衰期较短,需要持续静脉输注以维持治疗血清浓度。为了克服这一限制并进一步降低治疗成本,HLE-BiTE(Half-life extended BiTE)通过在BiTE分子中添加Fc结构域设计而成,延长药物的半衰期,从而延长患者的给药间隔。然而,延长的血清药物浓度可能会导致与经典BiTE相比更高的毒性,并且Fc结构域与其在多种免疫细胞上的受体之间的相互作用可以诱导非特异性免疫激活,如抗体依赖的细胞介导的细胞毒性(ADCC),这会导致不必要的毒性。因此,通过引入点突变来消除Fc受体与Fc结构域的结合,开发出了具有静默Fc结构域的抗体,以减少或避免不必要的效应功能,同时保留延长半衰期的能力。
Fig.3 HLE-BiTE的构建
BiTE可以通过哺乳动物细胞系大量生产,与CAR T细胞的漫长和复杂培养过程相比,BiTE的生产过程相对简单和快速,无需对T细胞进行基因改变或进行体外扩增/操作。在目前进行的临床研究数据显示,BiTE分子不仅可以作为单药治疗使用,也可联合其他治疗方案增强疗效。
BiTE的作用机制
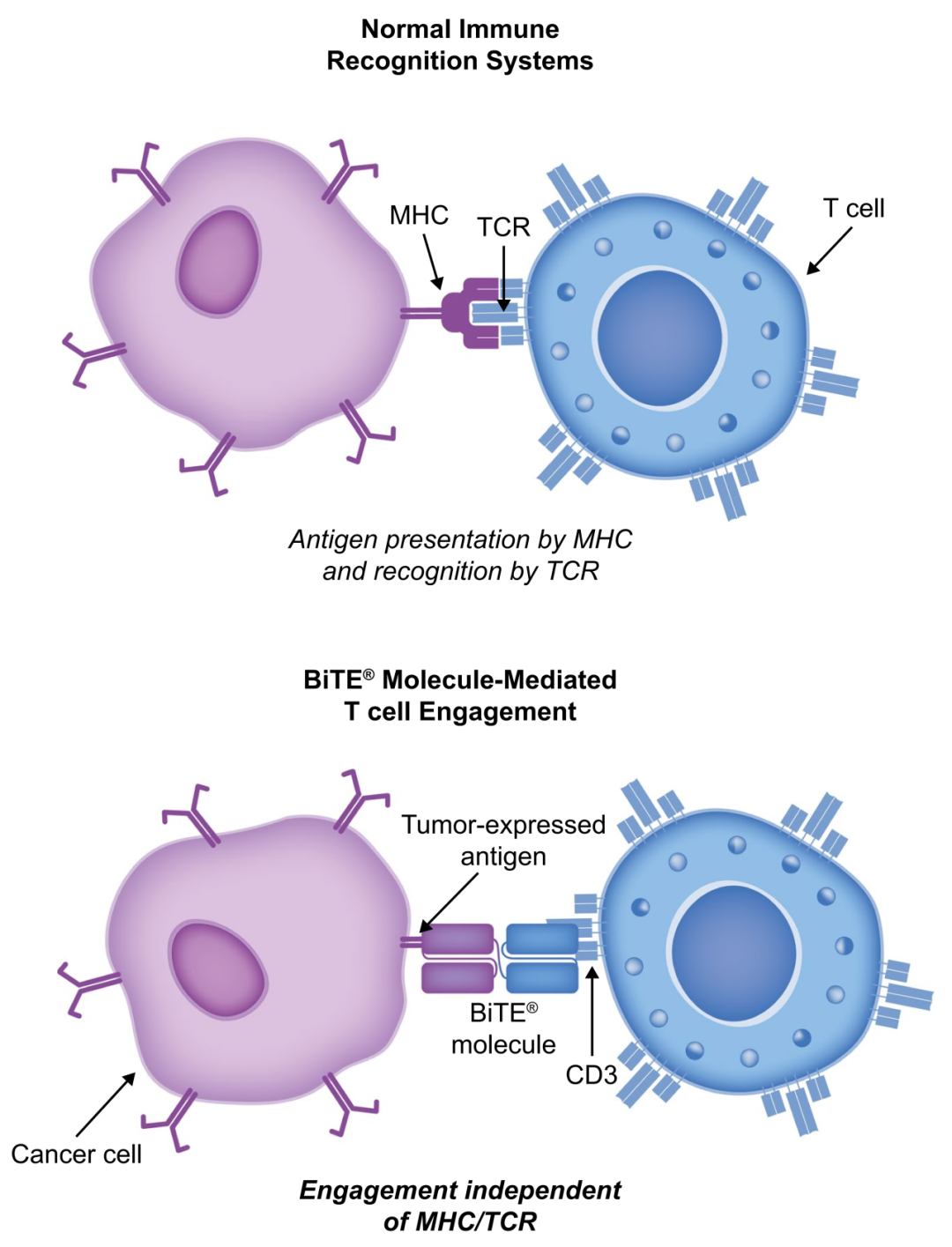
众所周知,在产生免疫应答过程中T细胞的激活需要双信号途径,正常情况下,肿瘤相关抗原(Anti-Tumor-Associated Antigens, TAAs)由表达在肿瘤细胞上的主要组织相容性复合体(Major Histocompatibility Complex, MHC)分子呈递,与T细胞上的TCR(T Cell Receptor)相互作用并诱导T细胞激活以消除肿瘤细胞。而肿瘤细胞逃避免疫监视的机制包括:第一,通过表达免疫抑制蛋白(如PD-L1、TGF-β和IL-10)刺激肿瘤细胞生长并阻断共刺激信号,从而导致T细胞反应受限;第二,下调MHC I类分子的表达,使得MHC分子呈递抗原能力的损害或丧失。这些也是对抗肿瘤治疗(如免疫检查点抑制剂疗法)产生耐药性,不能有效激活CD8+T细胞的原因。
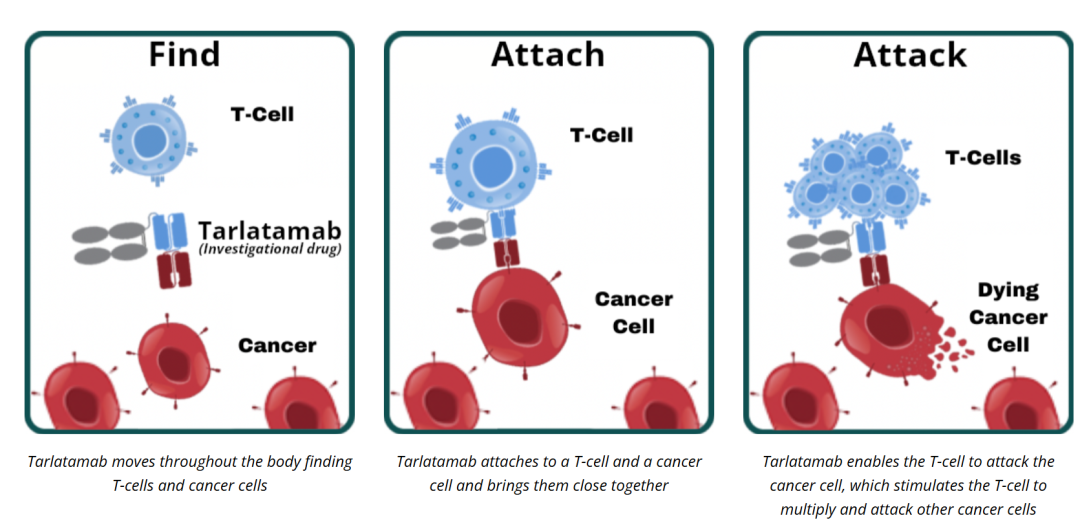
对于第一种免疫逃逸方式,PD-(L)1抑制剂通过阻断PD-1/PD-L1免疫抑制通路,解除对于T细胞免疫功能的抑制,恢复T细胞功能。而对于第二种免疫逃逸方式,BiTE可以独立于MHC限制,克服肿瘤MHC下调的问题,像桥梁一样交联细胞毒性T细胞和肿瘤细胞,然后激活T细胞并使其增殖,诱导免疫突触的形成。这些激活的T细胞在免疫突触间释放细胞毒性穿孔素和颗粒酶B,从而导致肿瘤细胞裂解。在细胞模型中,与其他双特异性抗体和单克隆IgG抗体相比,BiTE在肿瘤细胞溶解方面的效力高出100到10,000倍。
Fig.4 BiTE无需MHC/TCR识别机制即可激活T细胞杀伤肿瘤细胞
DLL3 (Delta-like protein 3)和CD3 (Cluster of Differentiation 3)
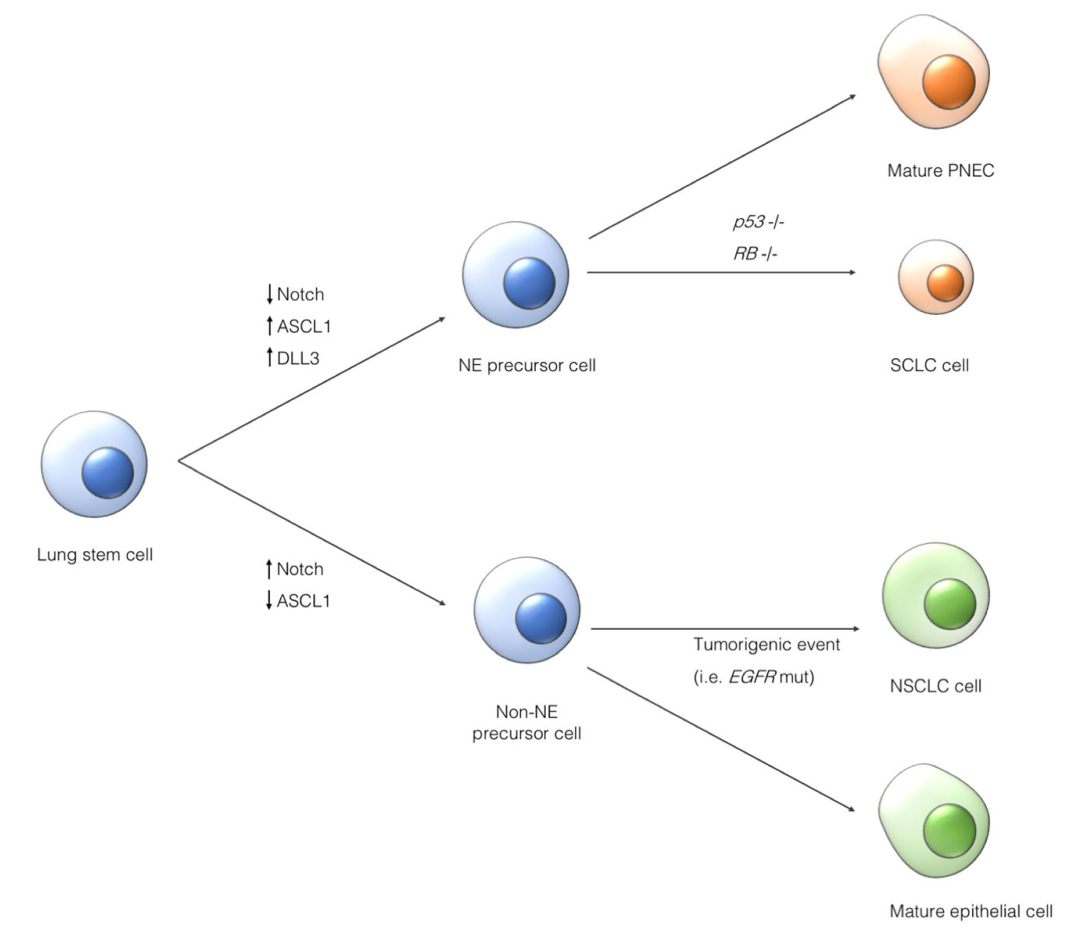
Notch信号通路是一种高度保守的细胞间信号通路,参与包括肺神经内分泌细胞等多种细胞的发育过程。Notch的失活会使肺干细胞向神经内分泌(NE)前体细胞转化,并通过双等位基因p53/RB丧失促进原发性小细胞肺癌(SCLC)的发生。
Fig.5 Notch信号通路和小细胞肺癌
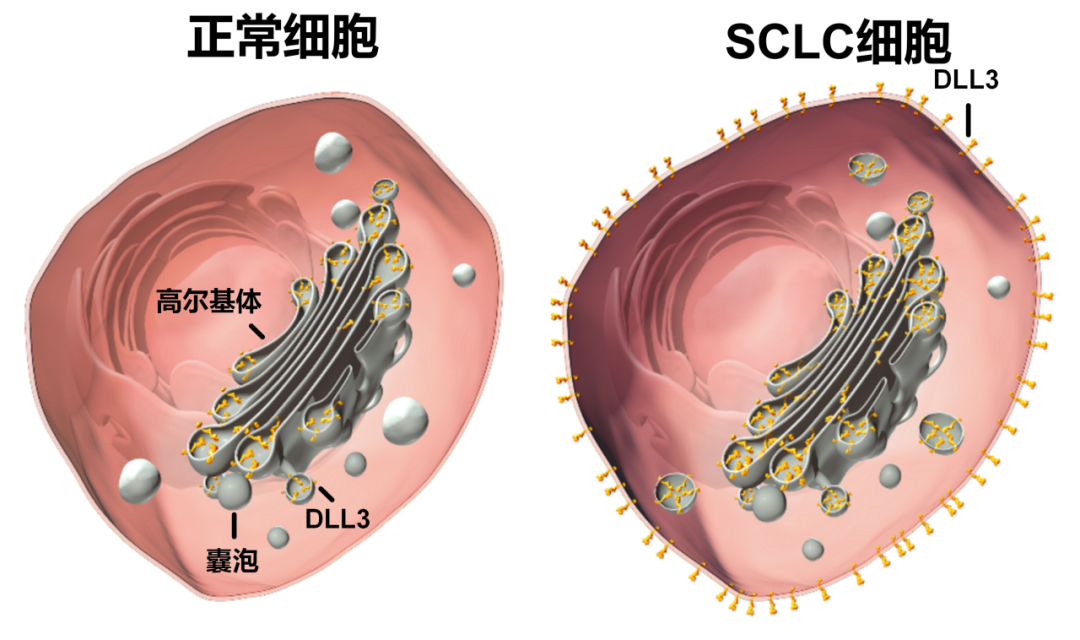
Delta样配体3(DLL3)是一种抑制性Notch通路配体,在小细胞肺癌(SCLC)和其他高等级神经内分泌肿瘤的细胞表面高度上调和异常表达。相比之下,只有少数正常细胞类型表达DLL3(例如神经元、胰腺岛细胞和垂体细胞),且DLL3的表达仅限于细胞质。Notch信号在神经内分泌肿瘤生长过程中下调,并受到DLL3表达的抑制。DLL3的表达受Achaete-Scute同源物1(ASCL1)调控,ASCL1是一种转录因子,对于肺神经内分泌细胞的正常发育是必需的,并且在SCLC中是致癌驱动因子。DLL3的表达特征——在肿瘤中高且均匀的细胞表面表达,与在部分正常组织中低且细胞质表达的差异——使得开发利用DLL3专门靶向SCLC细胞的治疗药物成为可能。
Fig.6 DLL3的表达特征
抑制DLL3可以恢复Notch的激活,从而降低ASCL1的表达,减少与更加侵袭性肿瘤行为相关的神经内分泌表型。
CD3分子主要表达在T细胞表面,是T细胞受体(TCR)复合物的一部分,由多个亚单位组成,包括CD3γ、CD3δ、CD3ε和CD3ζ,这些亚单位共同参与TCR信号传导。CD3的激活能够促进T细胞的增殖和分化,使其能够有效地执行免疫功能。
TCE药物的开发
塔拉妥单抗 AMG 757是一种半衰期延长的双特异性T细胞衔接器(HLE BiTE)抗体构造,包含一个结合DLL3的单链(scFv)结构域和一个结合CD3ε(T细胞受体复合物的一个不变部分)的scFv结构域,以及一个静默的Fc结构域。塔拉妥单抗能够同时结合DLL3阳性的肿瘤细胞与CD3阳性的T细胞,激活T细胞并定向引导其特异性杀伤表达DLL3的肿瘤细胞的机制。基于这种特殊的药物结构设计,塔拉妥单抗同时呈现出了免疫治疗的长期生存、持久缓解与靶向治疗的高缓解、低毒并存的双重特征。
免疫端:长生存,缓解持久:
塔拉妥单抗对比化疗治疗二线SCLC的Ⅲ期临床研究DeLLphi-304显示,塔拉妥单抗对比化疗显著延长中位OS(13.6个月vs 8.3个月,HR=0.60,P<0.001),死亡风险降低40%,缓解更持久,中位DOR为6.9个月vs 5.5个月,12个月持续缓解率为41% vs 13%。
靶向端:高缓解,低毒:
塔拉妥单抗对比化疗治疗二线SCLC的Ⅲ期临床研究DeLLphi-304显示,塔拉妥单抗对比化疗ORR提高了15% ( 35% vs 20%);≥3级TRAEs分别为27% vs 62%,导致剂量中断/剂量减少的TRAEs分别为19% vs 55%。
塔拉妥单抗已经于2024年5月获得FDA加速批准,用于治疗接受铂类化疗后疾病进展的广泛期小细胞肺癌(ES-SCLC)成人患者。基于DeLLphi-304和DeLLphi-307研究所获得的积极结果,国内用于小细胞肺癌三线及以上治疗,用于小细胞肺癌二线治疗的上市许可申请(BLA)也已获受理。塔拉妥单抗有望为中国SCLC患者的二线、三线及后线治疗提供新的用药选择。
Fig.7 塔拉妥单抗结构和作用
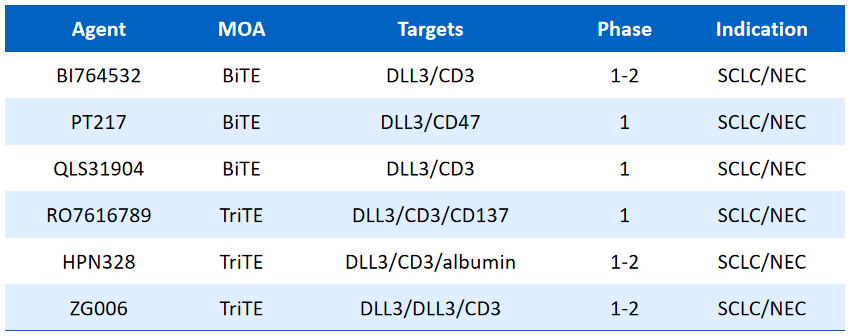
另外,多个TCE类药物的探索也正在进行。在一项Ⅰb期研究DAREONTM-9中,探索了DLL3/CD3双特异性T细胞衔接器Obrixtamig(BI 764532)与拓扑替康联合二线治疗小细胞肺癌(SCLC)患者,结果显示,患者的未确认客观反应率为70%,且耐受良好。ZG006是一种针对CD3/DLL3/DLL3的三特异性T细胞衔接器,在一项针对至少接受过两线标准治疗失败后的SCLC患者的Ⅱ期剂量扩展研究中,总体客观反应率为66.7%,疾病控制率为92.6%。持续缓解时间和无进展生存期的数据尚未成熟。
Table 1:正在开展的其它TCE药物研究
激发免疫系统的内在力量来靶向清除肿瘤细胞已成为治疗各种癌症的思路。特别是基于T细胞衔接器(TCE)的治疗方法在不同瘤种中开始逐渐显示治疗潜力。为了更好的恢复T细胞抵抗力并克服肿瘤免疫逃逸,研究者们正在探索ICIs和TCE的各种联合治疗策略场内配资平台,让我们一起期待这些临床试验能够呈现更有价值的研究结果。
盈富优配提示:文章来自网络,不代表本站观点。